4. Химическое сродство
Задачи контрольной работы
31. Теплоты образования
оксида (II) и оксида (IV) азота соответственно равны +90,37 кДж и +33,85 кДж. Определите
для реакций получения NO и NO2 из простых веществ. Можно ли получить эти оксиды при стандартных условиях? Какой из оксидов образуется при высокой температуре? Почему?
32. При какой температуре наступит равновесие системы 4HCl(г)+O2(г)
2H2O(г)+2Cl2(г);
Н= -114,42 кДж? Хлор или кислород в этой системе является более сильным окислителем и при каких температурах?
33. Восстановление Fe3O4 оксидом углерода идет по уравнению Fe3O4(к)+CO(г)=3FeO(к)+CO2(г). Вычислите
и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно
в этом процессе?
34. Реакция горения ацетилена идет по уравнению C2H2(г)+5/2O2(г)=2CO2(г)+H2O(ж) . Вычислите
. Объясните уменьшение энтропии в результате этой реакции.
35. Прямая или обратная реакция будет протекать при стандартных условиях в системе 2NO(г)+O2(г)
2NO2(г) Ответ мотивируйте, вычислив
прямой реакции.
36. Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите
реакции, протекающей по уравнению NH2(Г)+HCl(Г)=NH4Cl(К). Может ли эта реакция при стандартных условиях идти самопроизвольно?
37. Эндотермическая реакция взаимодействия метана с диоксидом углерода протекает по уравнению: CH4(Г)+CO2(Г)=2CO(Г)+2H2(Г) ;
H= +247,37 кДж. При какой температуре начнется эта реакция?
38. Определите
реакции, протекающей по уравнению : 4HN3(Г)+5O2(Г)=4NO(Г)+6H2O(Г). Вычисления сделайте на основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ. Возможна ли эта реакция при стандартных условиях?
39. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите
реакции, протекающей по уравнению : CO2(Г)+4H2(Г)=CH4(Г)+2H2O(Ж). Возможна ли эта реакция при стандартных условиях?
40. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите
реакции, протекающей по уравнению : CO(Г)+3H2(Г)=CH4(Г)+H2O(Ж). Возможна ли эта реакция при стандартных условиях?
Пример решения задач к разделу 4
Стандартные значения энергии Гиббса и энтропии.
Вещество |
Вещество |
||
BaCO3(к) |
-1138.8 |
C(алмаз) |
2.44 |
CaCO3(к) |
-1128.75 |
C(графит) |
5.69 |
Fe3O4(к) |
-1014.2 |
S(ромб) |
31.9 |
BeCO3(к) |
-944.75 |
FeO(к) |
54 |
CaO(к) |
-604.2 |
H2O(ж) |
69.94 |
BeO(к) |
-581.61 |
NH4Cl(к) |
94.5 |
BaO(к) |
-528.4 |
CH3OH(ж) |
126.8 |
CO2(г) |
-394.38 |
H2(г) |
130.59 |
FeO(к) |
-244.3 |
Fe3O4(к) |
146.4 |
H2O(ж) |
-237.19 |
CH4(г) |
186.19 |
H2O(г) |
-228.59 |
HCl(г) |
186.68 |
CO(г) |
-137.27 |
H2O(г) |
188.72 |
CH4(г) |
-50.79 |
N2(г) |
191.49 |
NO2(г) |
+51.84 |
NH3(г) |
192.5 |
NO(г) |
+86.69 |
CO(г) |
197.91 |
C2H2(г)
|
+209.2 |
C2H2(г) |
200.82 |
- |
- |
O2(г) |
205.03 |
- |
- |
H2S(г) |
205.64 |
- |
- |
NO(г) |
210.2 |
- |
- |
CO2(г) |
213.65 |
- |
- |
C2H4(г) |
219.45 |
- |
- |
Cl2(г) |
222.95 |
- |
- |
NO2(г) |
240.46 |
- |
- |
PCl3(г) |
311.66 |
- |
- |
PCl5(г) |
352.71 |
Пример 1. Дано уравнение реакции:
3Fe2O3(к) + H2(г) = 2Fe3O4(к) + H2O(г)
Н , кДж/моль: -822,2; 0; -1117,1; -241,7;
S , Дж/моль К: 87,4; 130,5; 146,2; 188,7;
G, кДж/моль: -740,3; 0; -1014,2; -228,6;
Найти изменение энтальпии, и определить будет ли протекать процесс самопроизвольно при Т= 298, 500, 1000 К.
Решение
1. Определим изменение энтальпии:
Н= НКОН - НИСХ = (2 (-1117,1) + (-241,7)) - (3 (-822,2) + 0) = -9,3 кДж/моль
2. Определим изменение энтропии для определения энергии Гиббса
S = SКОН - SИСХ = (2*146,2 + 188,7) - ( 3*87,4 +130,5) = 88,4 Дж/моль К
3. Рассчитаем энергию Гиббса для трех температур.
G298 =
H - T
S = -9,3*103 - 298*88,4 = - 35,64 кДж/моль
G500 =
H - T
S = -9,3*103 - 500*88,4 = - 53,5 кДж/моль
G1000 =
H - T
S = -9,3*103 - 1000*88,4 = - 97,7 кДж/моль
Следовательно, энергия Гиббса отрицательная величина, поэтому процесс самопроизвольно протекать будет.
Пример 2.
Восстановление Fe2O3 водородом протекает по уравнению:
Fe2O3 (к) + 3H2 (г) = 2Fe (к) + 3H2O (г) ;Н = +96,61 кДж. Возможна ли реакция при стандартных условиях, если изменение энтропии
S=0,1387 кДж/моль*К.
При какой температуре начнется восстановление Fe2O3?
Решение.
Вычисляем
G реакции
G=
H -
S*T=96,61 - 298*0,1387= +55,28 кДж.
Так как
G >0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия).
Найдем температуру, при которой
G=0:
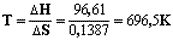
Следовательно при температуре
696,5 К начнется реакция восстановления Fe2O3 . Иногда эту температуру называют температурой начала реакции.